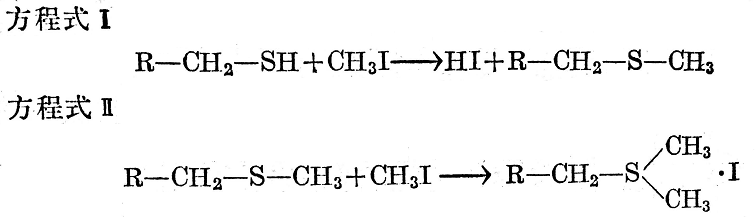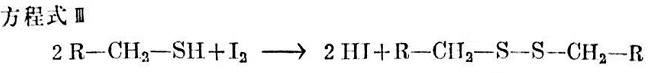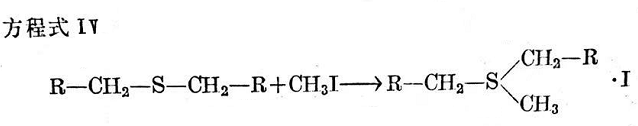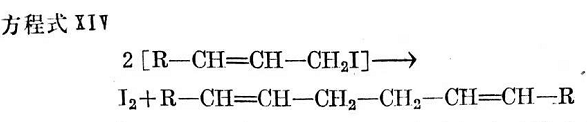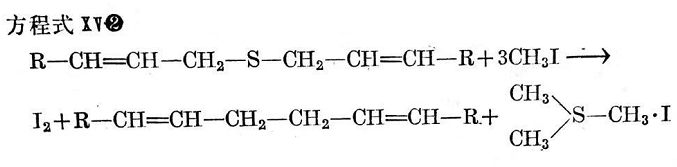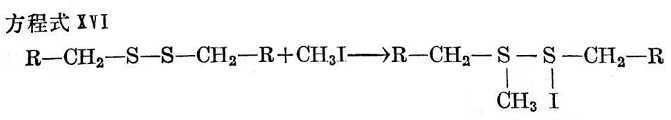3.1.3測定交聯(lián)鍵結構的最新分析方法
如前所述,只有引用各種現(xiàn)代分析方法,オ有可能說明交聯(lián)鍵的結構。由于說明二硫化秋蘭姆交聯(lián)鍵的結構是特別重要的,所以下面約略談談有關的分析方法。
3.1.3.1碘甲烷法
3.1.3.1.1方法原理
早在1935年,K.H.邁耶(K.H. Meyer)和W.霍海內(nèi)姆澤(W. Hohenemser)就發(fā)現(xiàn)硫化膠在過量的碘甲烷中浸泡幾天,碘甲烷本身就加到硫化膠上去。由此,他們假定碘甲烷可以與單硫醚起化學反應。他們還發(fā)現(xiàn),硫醇基不發(fā)生反應。
共他作者也進一步考察了硫化膠和碘甲烷之間的反應。關于這一課題,近來M.L.塞爾克和A.R.肯普0-610作了大量工作。其結果可概括如下:
硫醇與乙醇溶液中的碘甲烷反應,按方程式工和Ⅱ生成二甲基烷基锍之碘化物。
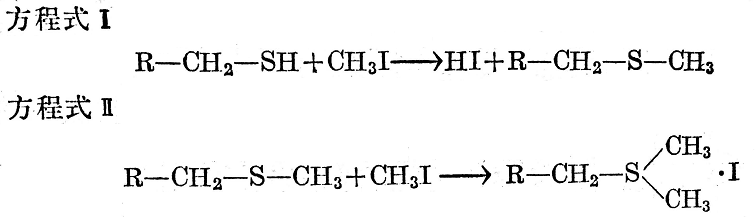
當游離碘存在時,相當數(shù)量的硫醇按方程式Ⅲ反應,而得到二烷基二硫化物。
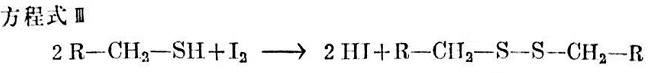
二烷基二硫化物與碘甲烷反應可以轉化為相應的碘化锍。
當二烷基一硫化物與碘甲烷反應時,按方程式IV與后者加成而得到相應的碘化锍。
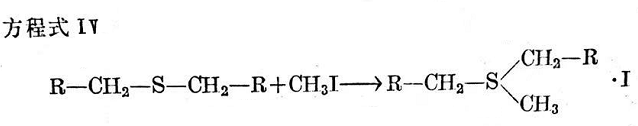
若有過量的碘甲烷,烷基可與甲基換位,這曾由M.L.塞爾克解釋如下(見方程式V~Ⅶ)。
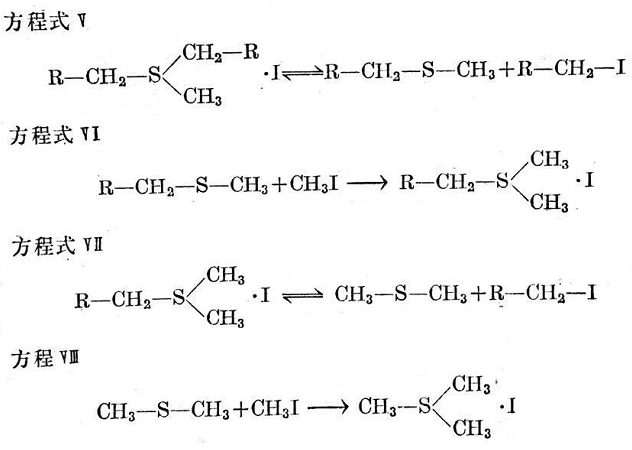
但據(jù)說上述反應是非常慢的,而且烷基甲基一硫化物是作為一種中間產(chǎn)物出現(xiàn)的。由于反應V~Ⅷ的速度慢,所以在分析溫度比較低時(如20℃),只發(fā)現(xiàn)方程式IV所形成的反應產(chǎn)物。在這些條件下,檢出甲基锍碘化物的量,就是衡量烷基鍵合單硫鍵鍵數(shù)的一個尺度。
烯丙基一硫化物最初按方程式IX反應。
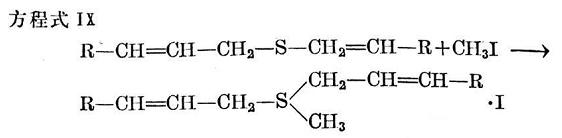
但是,作為初步產(chǎn)物而形成的二烯丙基甲基锍之碘化物是不穩(wěn)定的。在進一步反應中,烯丙基就較快地陸續(xù)交換為甲基。以這種方式反應的最終產(chǎn)物是碘化三甲基锍。這些反應進行得非常快,并經(jīng)M.L.塞爾克以及F.E.雷(F.E.Ray)和J.菜文(J. Levine)解釋如下50(方程式X~XⅢ)。
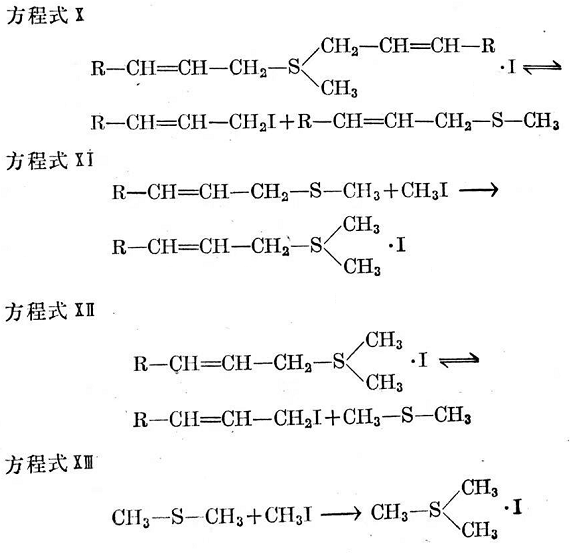
按方程式X和M0所形成之烯丙基碘,據(jù)信能以方程式IV產(chǎn)生二聚作用并分裂出碘。
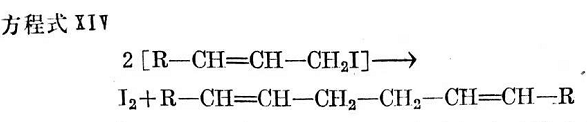
在24℃的反應中所形成的碘量可以通過滴定進行測定,當不存在硫醇時(參見方程式Ⅲ),成為衡量烯丙基鍵合單硫鍵的尺度。
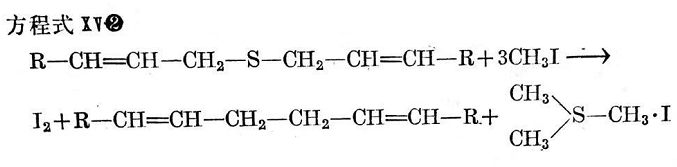
脂肪族二硫化物與碘甲烷的反應特別慢,或者在升高溫度以前根本就不發(fā)生反應,每克分子二硫化物消耗四克分子碘甲烷。按O.哈斯(O,Haas)和G.多爾蒂(G. Dougherter)510的說法,碘甲烷和二硫化物首先按方程式XVI形成一疏松的加成產(chǎn)物。
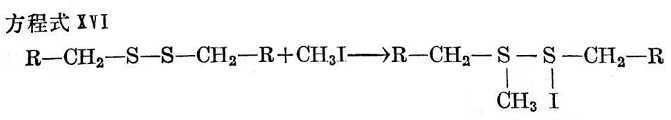
然后它再裂解為烷基甲基一硫化物和烷硫基碘(見方程式XⅦ)
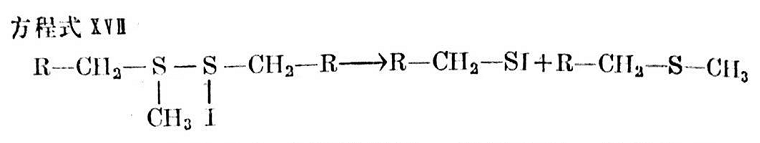
按方程式XⅧⅢ與碘甲烷的進一步反應時,設想烷硫基碘裂解出碘并形成甲基一硫化物。據(jù)信按方程式XW和X所生成的烷基甲基一硫化物最終按方程式XIX反應得到碘化硫。

據(jù)此,硫從硫化膠中分離出來的容易程度,將取決于硫的類型及其與雙鍵的相對位置。當硫位于a-次甲基碳原子時,它就能被硫化膠釋放出來,并按方程式X形成三甲基锍的碘化物。
如果交聯(lián)鍵是通過雙鍵的裂解而形成的,即如硫是在烷基位置上的話,則碘甲烷加成得碘化锍(參看方程式XIX)。這意味著當多數(shù)硫能被碘甲烷抽岀時,硫就鍵合到雙鍵的α-次甲基碳原子上去。碘甲烷與雙硫鍵或多硫鍵的反應較之單硫鍵慢得多,但這一反應大大取決于溫度。在比較低的溫度下(如24℃),實際上只有單硫鍵參與反應。
3.1.2分析步驟
將0.2~0.3克的預先經(jīng)過抽提完全除去游離硫的橡膠剪碎,并置于盛57克(25毫升)純碘甲烷的125毫升真空燒瓶內(nèi),排凈空氣并引入純氮。然后把樣品在24°0下避光停放500小時。當反應結東時,在高真空條件下蒸出剩余碘甲烷,并在高真空中,在60℃下進行干燥。先將所有形成的三甲基锍碘化物用丙酮抽提掉,然后測定硫量,可用硫化鈉方法測定之。或者,如有足夠的樣品時,可按美國材料試驗學會(ASTM)的硝酸氧化方法或用高氯酸半徽量法進行測定。游離硫是在帕爾筒內(nèi)用硫代硫酸鹽滴定測得,而總碘量用伊萊克(Elek)和R.A.哈特( Harte)的方法測定。
反應后仍然鍵合的硫,用差示法確定,即求得總硫量與游離硫之差便是這種硫的量。假若在碘甲烷處理前,總交聯(lián)數(shù)警如已經(jīng)用溶脹法四確定,即可根據(jù)剩余的交聯(lián)鍵估算交聯(lián)鍵斷裂數(shù)。這一數(shù)字相當于烯丙基鍵合的硫醚基(単硫鍵),也相當于釋放出的硫量。